临床试验项目立项工作指引
一、立项前沟通
1.申办方若有意在本院开展临床试验,请与临床试验机构办公室联系商洽合作意向,或下载填写临床试验信息简表,并附临床试验方案摘要、临床试验批件,发邮件至机构邮箱。
2.机构审核后,1个工作日内邮件回复意见。
二、立项审批流程
1.下载临床试验立项资料递交清单(下载专区),按照要求准备相关资料。
2.相关文件准备齐全后,将电子版材料以压缩包形式发送至机构邮箱进行初审(邮件主题:科室- PI -药品名称-立项材料),机构审核后将意见反馈给申办方/CRO,申办方/CRO应按照机构意见进行修改、补充或说明。
3.初审通过后,CRA递交纸质版材料(申办方盖章版)至机构办公室复审,纸质版材料需与审核通过的电子版保持一致,机构秘书将于3个工作日内回复审查意见。
4.机构办公室主任签署审批意见,审查通过后,下发立项通知函。
5.本中心可实行立项、伦理审查、协议审核同步推进,申办方递交纸质版立项资料时,可与伦理秘书联系并递交伦理审查资料,由伦理秘书安排上会时间。伦理审查申请指南详见https://zzslyy.com.cn/shownews?newsid=11355。
三、材料递交要求
1.所有递交资料应与伦理资料一致。
2.主要研究者按照立项审查表中相关内容进行专业评估,与立项申请表一同提交。
3.按递交材料目录顺序准备相关资料,纸质版、电子版各一份。
4.纸质版材料递交要求: 1)以“文件夹”的形式提交,按照递交资料目录顺序放置; 2)不同内容的材料之间有分隔页; 3)文件夹3寸、黑色、硬壳、两孔,所有材料左侧打孔;4)所有文件签字、盖章完整。
四、机构信息
机构办公地址:山东省枣庄市市中区龙头中路41号枣庄市立医院本部1号楼2楼药物临床试验基地GCP办公室
机构办公室电话:0632-3227561
机构办公室邮箱:zzslgcp@163.com
伦理办公室电话:0632-3227556
伦理办公室邮箱:zzslgcpll@163.com
工作时间:周一至周五
5月1日至9月30日
上午8:00-12:00 下午14:00-18:00
10月1日至次年4月30日
上午8:00-12:00 下午13:30-17:30
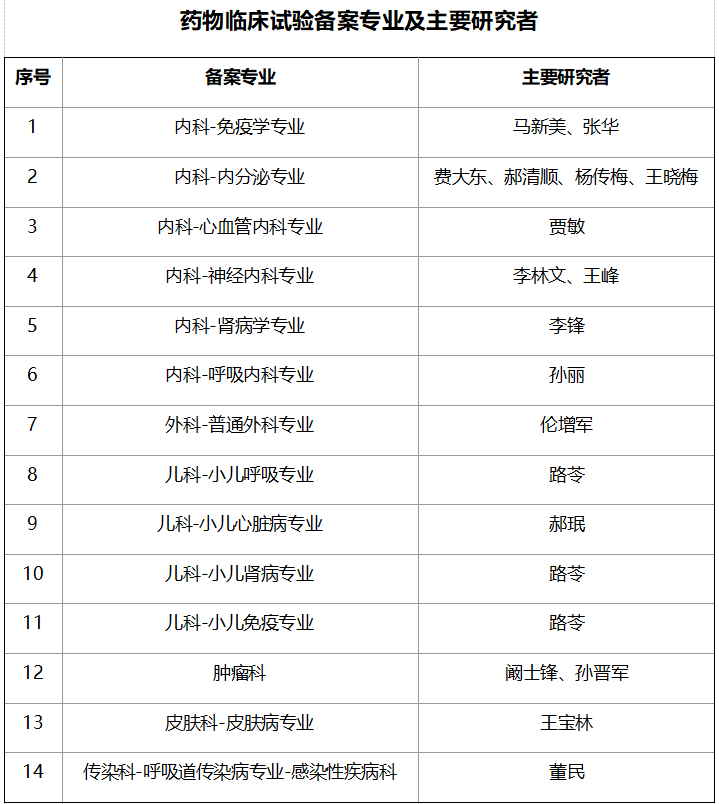
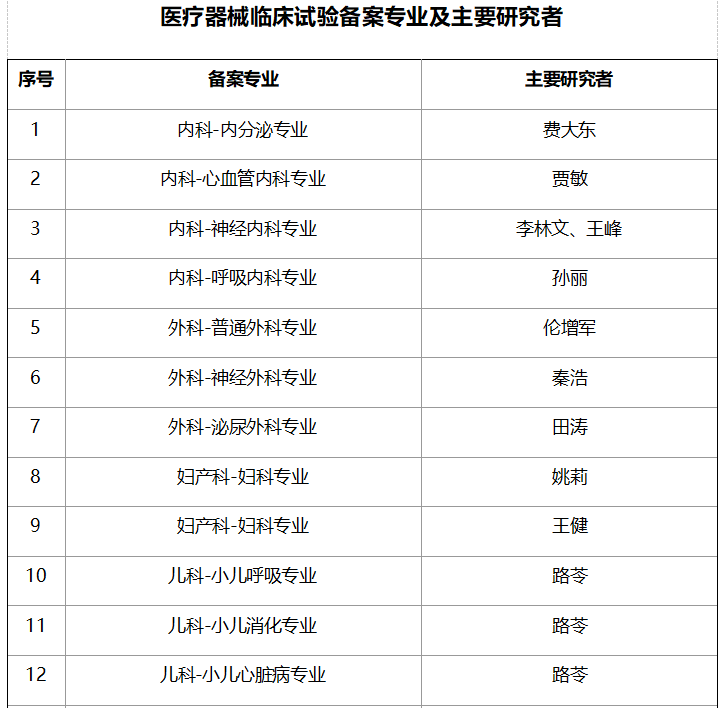
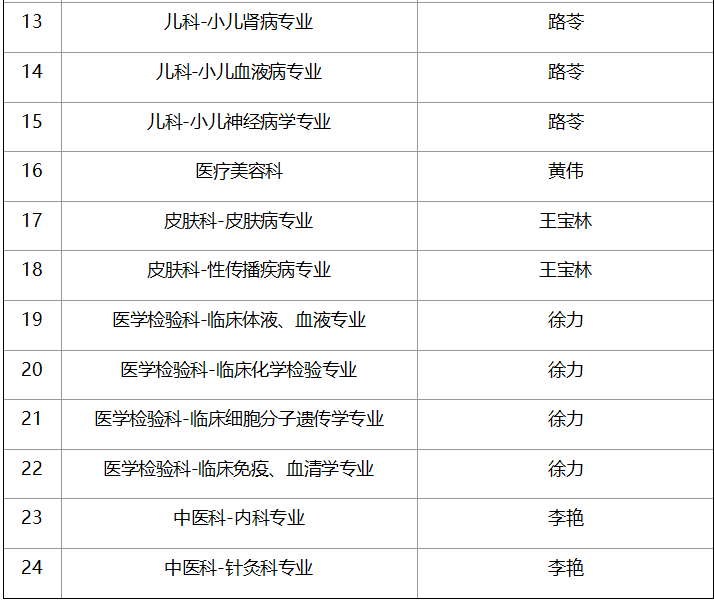
五、临床试验专业及PI一览表